-
Partager cette page
Des mues de Limulus polyphemus (Linnaeus, 1758)
Michèle Loneux - Muséum de Zoologie et d’Anthropologie
Vous avez dit limule ?
En mars 2024, un don de quelques grandes mues de Limulus polyphemus femelles originaires de la côte Est des États-Unis est venu enrichir les collections du Muséum de zoologie de l’ULB. Ces belles pièces entières ont été collectées en 1984 et sont très bien conservées. Elles n’en demeurent pas moins fragiles et cassantes.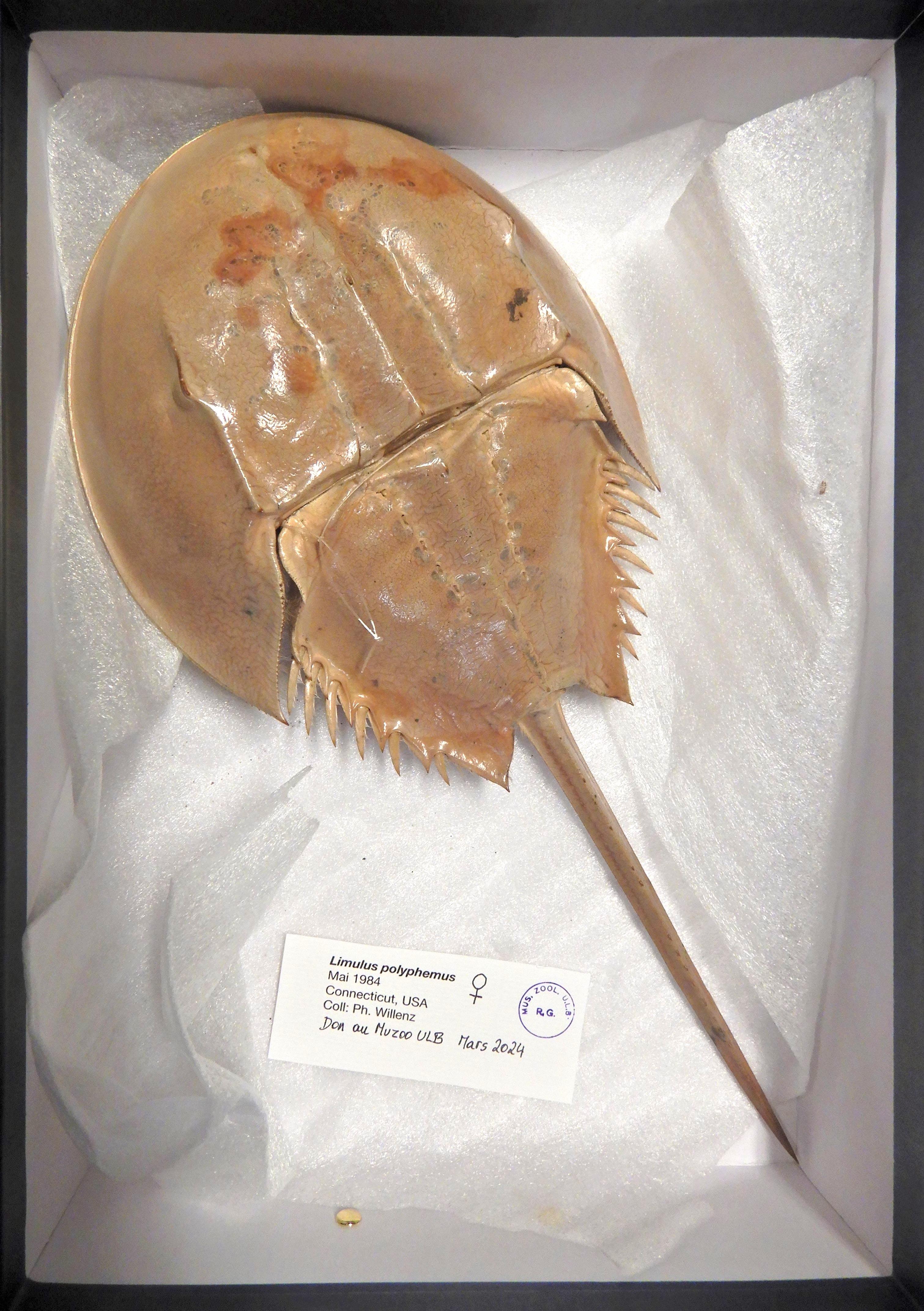
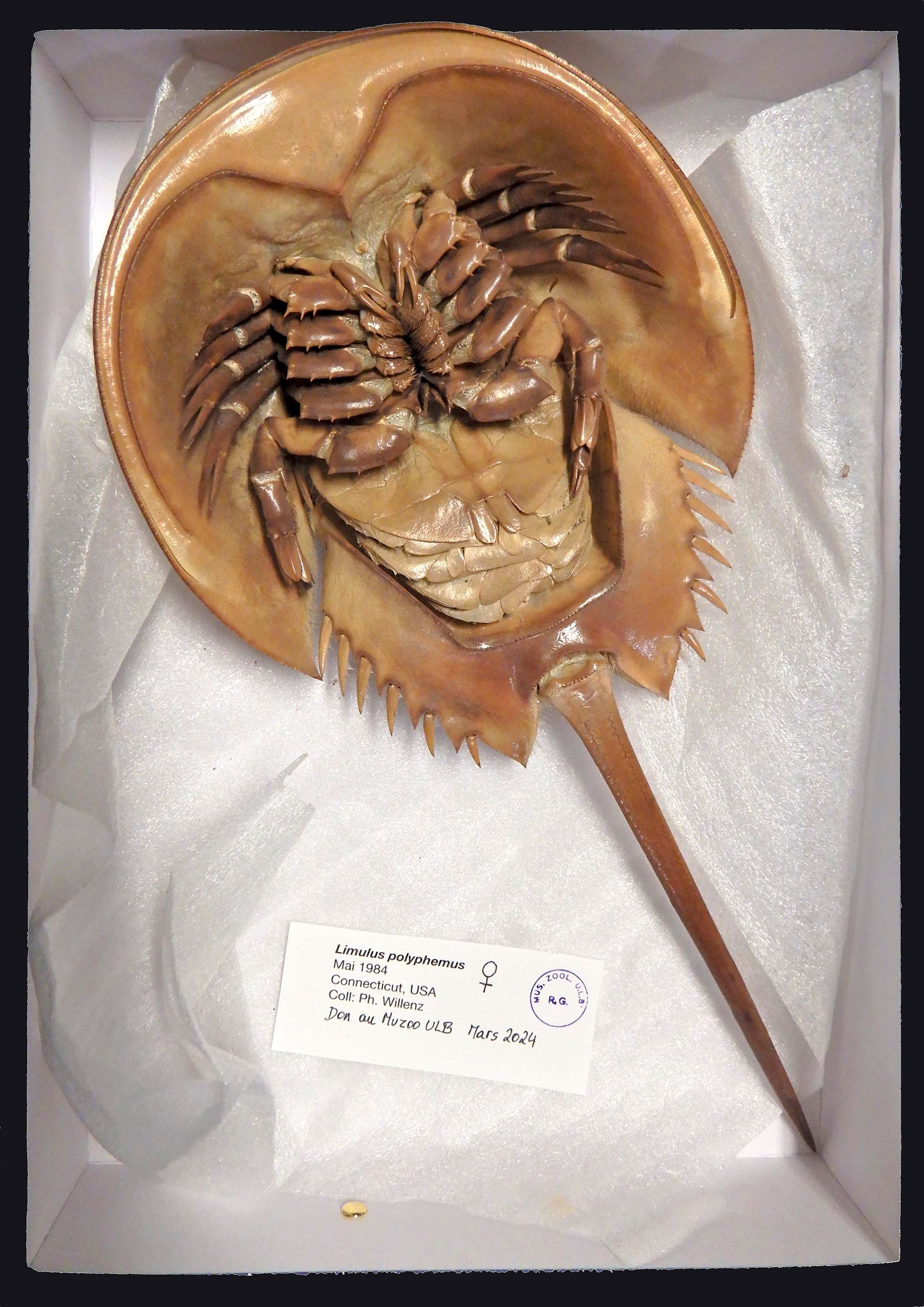
Fig. 1 & 2. Mue de Limulus polyphemus, face dorsale (1) et face ventrale (2), l’une des quatre grandes exuvies reçues (Grand merci à Philippe Willenz pour ce don.) Cl. M. Loneux
Nommées « crabes fer-à-cheval », « crabes sabot de cheval » (« Horseshoe crabs » en anglais) ou encore « crabes au sang bleu », les limules ne sont pourtant pas des crabes. Leur forme bossue et arrondie évoque bien un sabot ou un fer à cheval, garni d’une queue rigide qui leur sert à se retourner, le telson (fig. 1). Vue par dessous (fig. 2 & 3), la limule dévoile cinq paires de pattes. Située près de la bouche, la première constitue les pédipalpes, qui dilacèrent les aliments et les portent à la bouche. Munies de petites pinces aux extrémités, les quatre paires suivantes sont ambulatoires. Elles sont aussi garnies de brosses de soies à la base de leur cuisse ; c’est le long de ces soies que sont acheminés les morceaux de nourriture triturée vers l’orifice buccal antérieur. Cette adaptation leur a valu le nom taxonomique de « Mérostomes », du grec meros (cuisse) et stoma (bouche).
La paire de chélicères (appendices céphaliques) situés en avant de la bouche (cf. les chélicères venimeux des araignées) classe les limules parmi les Chélicerates. Évolutivement parlant, elles partagent en effet plus de caractéristiques morphologiques héritées d’un ancêtre commun avec des Arachnides comme les araignées et les scorpions et en sont donc plus proches cousines. Les Crustacés comme les crabes, eux, sont munis notamment de mandibules et d’antennes, absentes chez les limules.
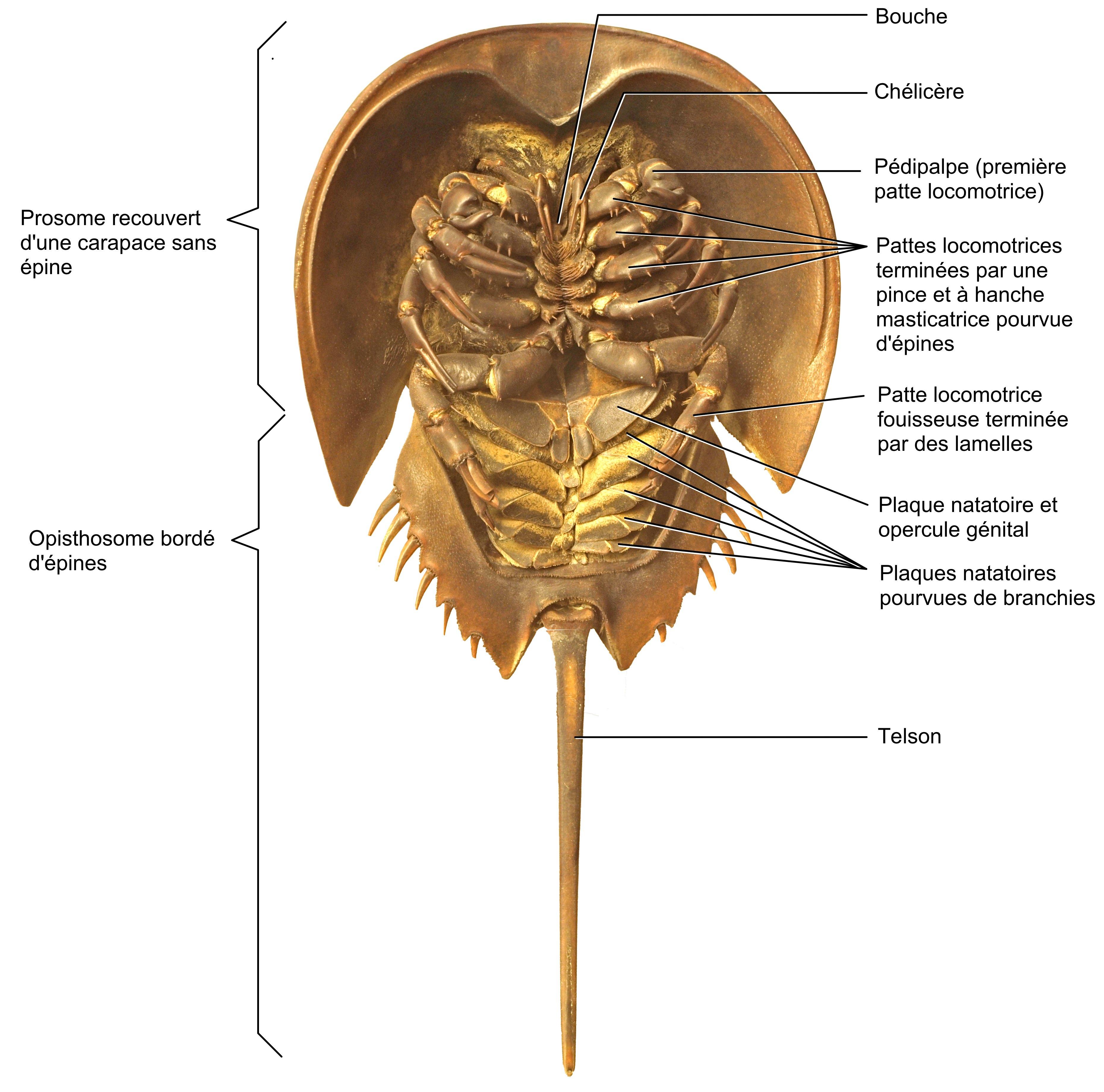
Fig. 3. Morphologie d’une limule (Limulus polyphemus, vue ventrale) détaillant les différentes parties - Cl. annoté E. Walravens
Les limules font effectivement partie de l’énorme embranchement des animaux à pattes articulées, les Arthropodes (1.150.000 espèces décrites, dont un million d’Hexapodes (insectes), 80.000 Arachnides, 60.000 Crustacés, etc.). Toutes les espèces de limules, éteintes comme récentes, sont regroupées dans un taxon qui leur est propre : les Xiphosures, du grec xiphos, épée, et uros, queue, soit « queue en épée ».
Les limules possèdent des branchies pour capter l’oxygène de l’eau et des palettes natatoires pour se déplacer en nageant, même si elles marchent plus qu’elles ne nagent (clip vidéo L. Ballesta – 57 sec. – et fig. 4). Elles portent dix yeux répartis sur les faces dorsale et ventrale, dont une paire d’yeux composés sur le dessus du prosome (partie avant du corps).

Fig. 4. Limulus polyphemus marchant sur le fond, aquarium de La Rochelle – Cl. E. Walravens
Les limules sont des animaux marins qui pondent leurs œufs collectivement et en masse à marée haute, sur des sites propices ancestraux auxquels elles sont fidèles, à la limite de l’estran et selon un cycle annuel et lunaire immuable, par pleine lune, généralement début juillet. Plus grande que le mâle, la femelle enfouit ses œufs dans le sable côtier à l’aide de sa dernière paire de pattes locomotrices, dont l’extrémité est pourvue d’un appendice fouisseur. Accroché à la femelle, le mâle féconde les œufs.
Les plages de sable de la côte Est nord-américaine sont ainsi devenues, depuis des milliers d’années (Buehler et al., 2006), une étape nourricière incontournable pour des milliers de bécasseaux maubèches et autres oiseaux limicoles migrateurs, qui dépendent des œufs de limule pour poursuivre leur long trajet migratoire (Baker et al., 2004; MacGowan et al., 2011; Piersma, 2007; Piersma & Davidson, 1992) .
Initialement très abondantes sur les côtes américaines, les limules sont récoltées en masse pour servir d’appâts pour la pêche. Depuis les années 1970, elles sont aussi récoltées en grand nombre en raison des particularités de leur sang : celui-ci est en effet de couleur bleue en raison de la présence de cuivre dans l’hémocyanine, protéine qui transporte le dioxygène chez les limules, un peu comme l’hémoglobine rouge le fait avec du fer chez les mammifères. Le sang des limules a la particularité de gélifier au contact de toxines de bactéries, ce qui permet de bloquer toute infection et empêcher ainsi tout inflammation. Cette propriété est mise à profit dans la recherche médicale pour détecter les contaminants bactériens dans des vaccins ou des médicaments, au détriment des limules, capturées en très grand nombre et affaiblies par les prélèvements. Même si elles sont marquées puis relâchées, des chercheurs ont estimé qu'au moins 30% d’entre elles n’y survivaient pas.
Vous avez dit mue ?
Comme tout arthropode, les limules sont protégées par une carapace à base de chitine, qui les habille comme une « armure de chevalier » rigide, peu extensible, mais permettant le mouvement grâce à des articulations, notamment au niveau des pattes (arthros, articulation et podos, pied, patte). Il s’agit de la cuticule ou exosquelette des arthropodes. Quand leur cuticule devient trop serrante et petite, ils doivent s’en extirper et en fabriquer une nouvelle. Les arthropodes grandissent donc par palier : c’est le processus de mue, qui nécessite plusieurs étapes. L’animal ne se nourrit plus et se met en repos pour muer.Des enzymes sécrétées en préparation digèrent partiellement la couche interne de leur carapace, qui est en contact avec la chair du corps, et permettent à la cuticule de se détacher du corps.
Quand les enzymes terminent leur travail de digestion dans toutes les parties de l’animal, la ligne principale d’ouverture de la carapace s’écarte comme une tirette, dans la courbure antérieure du prosome (fig. 5 & 6) et la limule peut sortir son corps mou et déformable tout en fabricant une nouvelle cuticule. Ce n’est pas un processus rapide : il lui faut plusieurs heures pour sécréter une nouvelle cuticule sur toute la surface de son corps (fig. 7) et plusieurs heures ou jours parfois pour que cette cuticule se solidifie progressivement et complètement (fig. 8). Les phases de sortie et de durcissement sont dangereuses pour l’animal, qui constitue alors une proie non protégée et facile pour tout prédateur…

Fig. 5. Mue de limule montrant la fente d’ouverture antérieure du prosome (colorée ici en vert), qui s’ouvre comme une
tirette courbe et permet à l’animal de sortir d’abord la partie la plus large de son corps – Cl. M. Loneux

Fig. 6. Même exuvie de limule, ouverture écartée pour montrer l’espace d’où est sorti le corps de l’animal - Cl. M. Loneux

Fig. 7. Exemple de phase de mue chez un crabe : la partie dorsale de la carapace du crabe se soulève comme un couvercle de boîte et lui permet de sortir sa partie la plus large, nue et relativement molle. La nouvelle couche de cuticule en formation est déjà un peu colorée - Cl. E. Walravens

Fig. 8. Exemple d’exuvie d’araignée à côté de la tégénaire qui a mué.
L’animal est recouvert de sa nouvelle carapace, déjà très foncée et probablement rigide. Les pattes de l’exuvie sont entières et reliées entre elles à leur base, mais la forme de la partie du corps n’est pas conservée, car l’arachnide déchire cette partie en sortant de sa cuticule – Cl. E. Walravens
L’enveloppe de cuticule qui subsiste après la sortie de l’animal et s’en détache en entier ou par morceaux s’appelle l’exuvie, plus communément la mue. Chez les limules, l’exuvie peut être parfaitement entière et offre dans ce cas un objet remarquable, qui montre tous les détails de la morphologie externe de l’animal, comme sur le spécimen des figures 1 et 2.
Comme d’autres arthropodes à croissance continue, les limules ne muent pas à intervalles réguliers, mais en fonction de leur âge, de leur taille et des conditions environnementales. En général, elles muent une quinzaine de fois au cours de leur vie, plus fréquemment quand elles sont jeunes, puis à des intervalles de temps de plus en plus longs. Elles sont matures entre 9 et 12 ans et peuvent vivre jusque 20 à 30 ans.
Pérennité et conservation des limules à l’état sauvage
Les limules sont souvent qualifiées de « fossiles vivants », car des espèces morphologiquement similaires vivaient déjà dans les mers de l’Ordovicien inférieur (il y a 480 millions d’années). Ainsi, Mesolimulus walchi, fossile des craies de Solnhofen, vivait au Jurassique supérieur (il y a 150 millions d’années) (fig. 9). Des 88 espèces de Xiphosures fossiles et récentes décrites, seules quatre sont vivantes de nos jours, rassemblées dans la famille des Limulidés. Elles sont actuellement plus ou moins menacées par l’activité humaine, que ce soit à cause de la surpêche ou de la destruction de leurs plages de reproduction ou de leur habitat sous-marin côtier. Leur sang bleu est précieux pour l'industrie biomédicale, ce qui conduit à une exploitation intensive. La limule Limulus polyphemus des côtes orientales américaines, objet de cette note, est la plus étudiée. Ses populations sont considérées comme « vulnérables » globalement par l’Union internationale pour la Conservation de la Nature (IUCN), même si certaines sont plus menacées que d’autres localement, selon les régions. Les trois autres espèces de limules habitent les côtes d’Indonésie, du Japon et des Philippines ; la limule des Philippines est en danger d’extinction (IUCN SSC Horseshoe Crabs Specialist Group, 2025). 
Fig. 9. Moulage du fossile Mesolimulus walchi, montrant l’aspect général - Muséum de zoologie, ULB – Cl. M. Loneux

Fig. 10. Limule à queue ronde ou Limule des Mangroves (Carcinoscorpius rotundicauda), habitant les côtes d’Indonésie et d’Asie du Sud-Est - Muséum de zoologie, ULB – Cl. M. Loneux
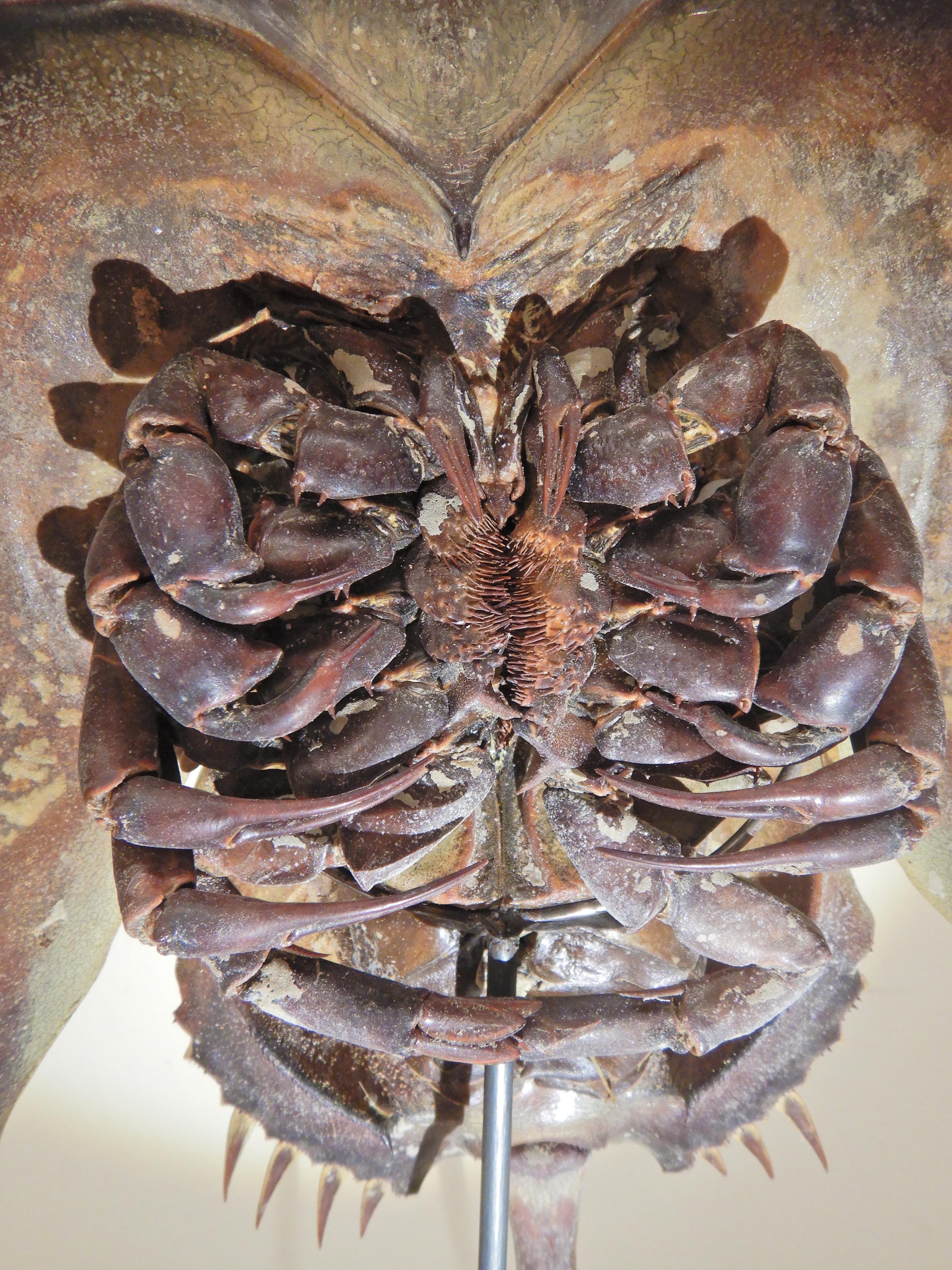
Fig. 11. Carcinoscorpius rotundicauda, Limule des mangroves. Face ventrale, détail des appendices du prosome – Muséum de zoologie, ULB – Cl. M. Loneux
Des efforts de conservation sont en cours pour protéger ces espèces, notamment des programmes de reproduction en captivité, l’adoption de réglementations quant à leur capture et même la mise au point d’un substitut de leur sang bleu pour les tests médicaux (Maloney et al., 2018).
Les limules sont des animaux fascinants. Ne manquez pas de visiter le site de la Horseshoe Crab Recovery Coalition pour en savoir plus sur tous les aspects de la limule fer à cheval de la côte atlantique américaine et sa conservation, d’une part, et, de l’autre, les articles scientifiques sur les relations écologiques étroites qui lient les limules à la survie des populations du fameux Bécasseau maubèche (Calidris canutus, Knot en anglais), et pourquoi particulièrement ce migrateur au long cours. C’est une autre histoire...
Notons que la physionomie de la limule a inspiré l’artiste suisse Giger pour le film Alien, le 8e passager (Ridley Scott, 1979), plus précisément les créatures larvaires (facehuggers ou « étreigneurs de visage ») qui éclosent des œufs du monstre et cherchent à s’agripper au visage d’autres êtres vivants pour leur implanter une larve dans l'estomac.
Pour en savoir plus
- Atlas photographique des espèces fossiles et récentes de limules connues en 2020 : Bicknell Russell D. C. & Pates Stephen, 2020: Pictorial Atlas of Fossil and Extant Horseshoe Crabs, With Focus on Xiphosurida. Front. Earth Sci., 09 July 2020, Sec. Paleontology, vol.8, 2020 https://doi.org/10.3389/feart.2020.00098 https://www.frontiersin.org/journals/earth-science/articles/10.3389/feart.2020.00098/full dont la fig. 34 pour la Mesolimilus walchi du Jurassique de Solnhofen (Allemagne)
- Horseshoe Crab Recovery Coalition HCRC : https://hscrabrecovery.org
- Dernières actualités sur les limules américaines resources : https://hscrabrecovery.org/news/
- Réponses en clips vidéo aux questions fréquentes sur les limules https://hscrabrecovery.org/resources/
- Science : https://hscrabrecovery.org/the-science/ évidence scientifique justifiant les objectifs de la coalition sur la côte américaine
- Le bécasseau maubèche et la limule : https://hscrabrecovery.org/shorebirds-and-horseshoe-crab- studies-on-delaware-bay-2024-guts-dont-fly/
- Informations du groupe des spécialistes de limules de l’UICN : https://iucn.org/our-union/commissions/group/iucn-ssc-horseshoe-crab-specialist-group, consulté le 09/08/2025
- McKeever, A. 2002 : National Geographic 275, Publication 6 août 2022, 11:00 CEST : https://www.nationalgeographic.fr/animaux/les-limules-creatures-au-sang-bleu-tres-recherchees-et-de-plus-en-plus-menacees, Photographies de Laurent Ballesta,
- Museum virtuel des Fossiles (1999-2016): http://www.fossilmuseum.net/, dont la Mesolimulus fossile du Jurassique de Solnhofen, http://www.fossilmuseum.net/Fossil_Sites/solnhofen/wesolimulus/wesolimulus-walchi.htm
- Réaction du sang des limules aux bactéries/toxines :
- Tous les animaux du Monde, T. 8. : Invertébrés, Les Mérostomes, Paris, Ed. Librairie Larousse, 1974, p. 181-18-19.
Bibliographie
- Alien - The Roleplaying Game: Building Better Worlds, Free League Publishing, 2024, p. 297-315.
- Allan J Baker, Patricia M González, Theunis Piersma, Lawrence J Niles, Inês de Lima Serrano do Nascimento, Philip W Atkinson, Nigel A Clark, Clive D T Minton, Mark K Peck, Geert Aarts 2004: Rapid population decline in red knots: fitness consequences of decreased refuelling rates and late arrival in Delaware Bay. (A propos des relations écologiques entre les limules et les oiseaux limicoles, dont le fameux Bécasseau maubèche Calidris canutus, un migrateur au long cours)
- Buehler, D.M., A.J. Baker & T. Piersma, “Reconstructing palaeoflyways of the late Pleistocene and early Holocene Red Knot Calidris canutus”. Ardea 94(3), 2006, p. 485–498.
- McGowan Conor, P., J.E. Hines, J.D. Nichols, J.E. Lyons, D.R. Smith, K.S. Kalasz, L.J. Niles, A.D. Dey, N.A. Clark, P.W. Atkinson, C.D. T. Minton & W. Kendall, “Demographic consequences of migratory stopover: linking red knot survival to horseshoe crab spawning abundance”. Ecosphere 2(6), art69, 2011, p. 1-22 (https://doi.org/10.1890/ES11-00106.1).
- Maloney, T., R. Phelan & N. Simmons, “Saving the horseshoe crab: A synthetic alternative to horseshoe crab blood for endotoxin detection”. PLoS Biology, 16(10), 2018 Oct 12, e2006607 (doi: 10.1371/journal.pbio.2006607. eCollection 2018 Oct. PMID: 30312293).
- Piersma, T., “Using the power of comparison to explain habitat use and migration strategies of shorebirds worldwide (Review)”. Journal of Ornithology, 148 (suppl 1), 2007, S45–S59 (DOI 10.1007/s10336-007-0240-3 https://www.roebuckbay.org.au/wp-content/uploads/2012/01/JOrnithol2007-shorebird-knot-flyway-comparisons-IOCplenary.pdf).
- Piersma, T. & N.C. Davidson, “The migrations and annual cycles of five subspecies of Knots in perspective”. Wader Study Group Bulletin, 64 (suppl. L), 1992, p. 187-197 (https://www.researchgate.net/publication/284660987_The_migrations_and_annual_cycles_of_five_subspecies_of_knots_in_perspective).
Clips vidéo recommandés :
- Limule Arte extrait interview Laurent Ballesta 0'57’’ : https://www.youtube.com/watch?v=mPwGKcqAjcI
- Limule : une fascination abyssale - Le dessous des images – ARTE (10’58’’) : https://www.youtube.com/watch?v=4iCFvu_HRAA
- Pourquoi les crabes fer à cheval viennent-ils chaque année dans le Massachusetts ? (9min 57sec) : https://www.youtube.com/watch?v=1Zdt7-S3kbc
- Horseshoe crab (2’ 44’’) : https://www.youtube.com/watch?v=zUaZfsrGqdg
- Comment un couple de limules se retourne ( 0’55’’) : https://www.youtube.com/watch?v=sxXrRtqkwCg
